EMT6-Luc:体内监测转移发展和治疗效果
作者:
Sheri Barnes博士,科学发展部副主任
日期:
2021年2月
乳腺癌是美国女性中最常见的癌症,也是女性癌症死亡的第二大原因。根据美国癌症协会的数据,到2020年,大约有279100个新病例被诊断出来,42690个病人死亡。1早期发现措施和改进的治疗方案使5年总生存率从1975年的75%提高到今天的90%或更高。2然而,尽管有良好的生存统计,转移性疾病是常见的乳腺癌,往往是死亡的原因。出于这个原因,重要的是要继续发展改善乳腺癌的治疗,影响转移性疾病。
通过免疫疗法成功治疗乳腺癌仍然是一个挑战,但新出现的临床数据令人鼓舞。三为了帮助开展乳腺癌免疫治疗的临yaboapp体育官网床前研究,Covance于2018年开发了原位EMT6同基因乳腺肿瘤模型. EMT6模型来源于BALB/c小鼠移植的肺泡增生性转移瘤。4随着该模型的进一步研究,40%的对照组小鼠在大体尸检时观察到肺转移灶。由于转移在乳腺癌患者中很常见,因此利用这一发现很重要,因此产生了一种荧光素酶激活的EMT6细胞系(EMT6-Luc)来通过生物发光成像(BLI)监测胸部转移体内. 在这个项目中,动物的护理和使用是根据动物福利条例在AAALAC认可的机构中进行的,并得到IACUC方案的审查和批准。
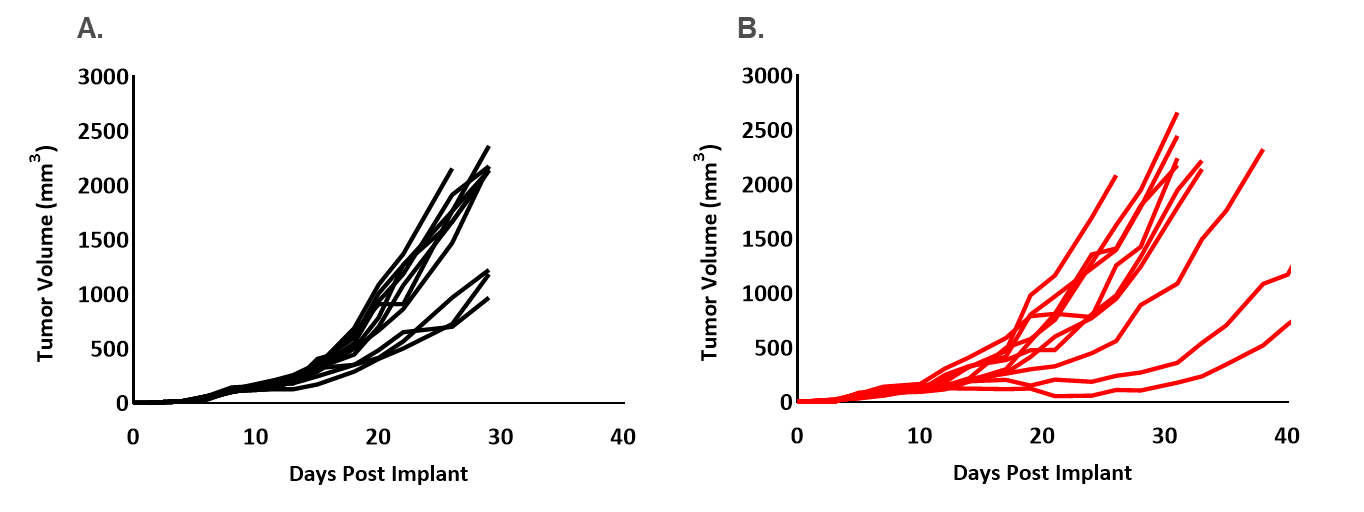
在这个聚光灯下,我们通过原发性肿瘤的卡尺测量和胸部区域的BLI监测转移性疾病进展,展示了我们将EMT6-Luc模型植入乳腺脂肪垫(MFP)的初步疗效研究数据。图1显示了EMT6和EMT6 Luc模型的控制肿瘤生长。对于父母和EMT6-Luc模型,MFP肿瘤的中位加倍时间为5.5天,允许两到三周的治疗窗口来评估试验药物的抗肿瘤活性。
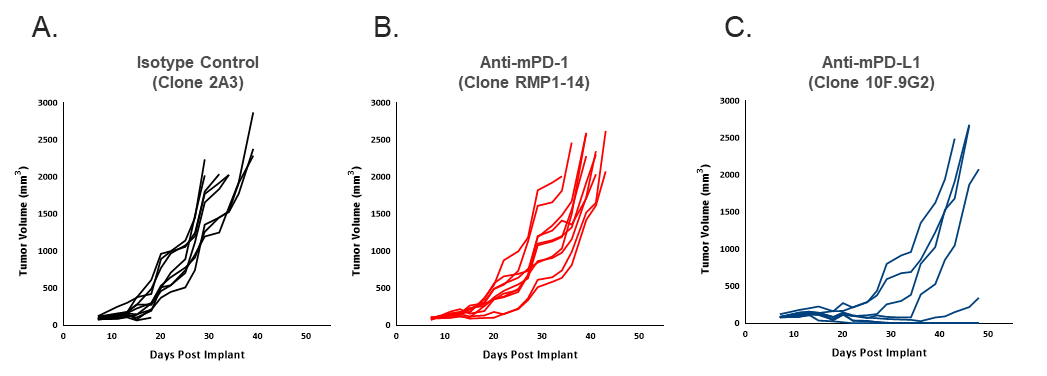
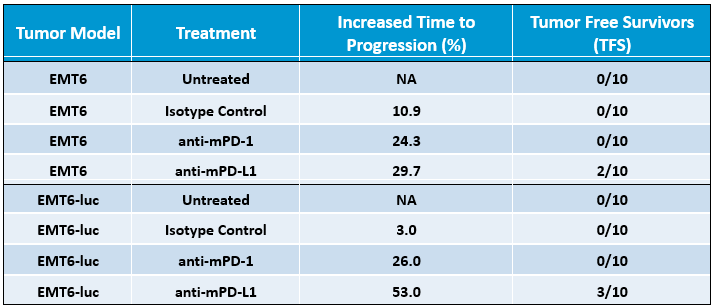
为了确定EMT6-Luc对检查点阻断的反应,用抗mPD-1或抗mPD-L1治疗携带EMT6-Luc肿瘤的小鼠。与对照组相比,对检查点阻断的反应中等(图2),对EMT6 Luc中抗mPD-1的反应与亲本产生的数据相似(表1)。与亲本系相比,EMT6 Luc对抗mPD-L1的应答似乎略有改善(表1),但在试验条件下添加荧光素酶标签对抗肿瘤疗效的总体影响似乎很小。
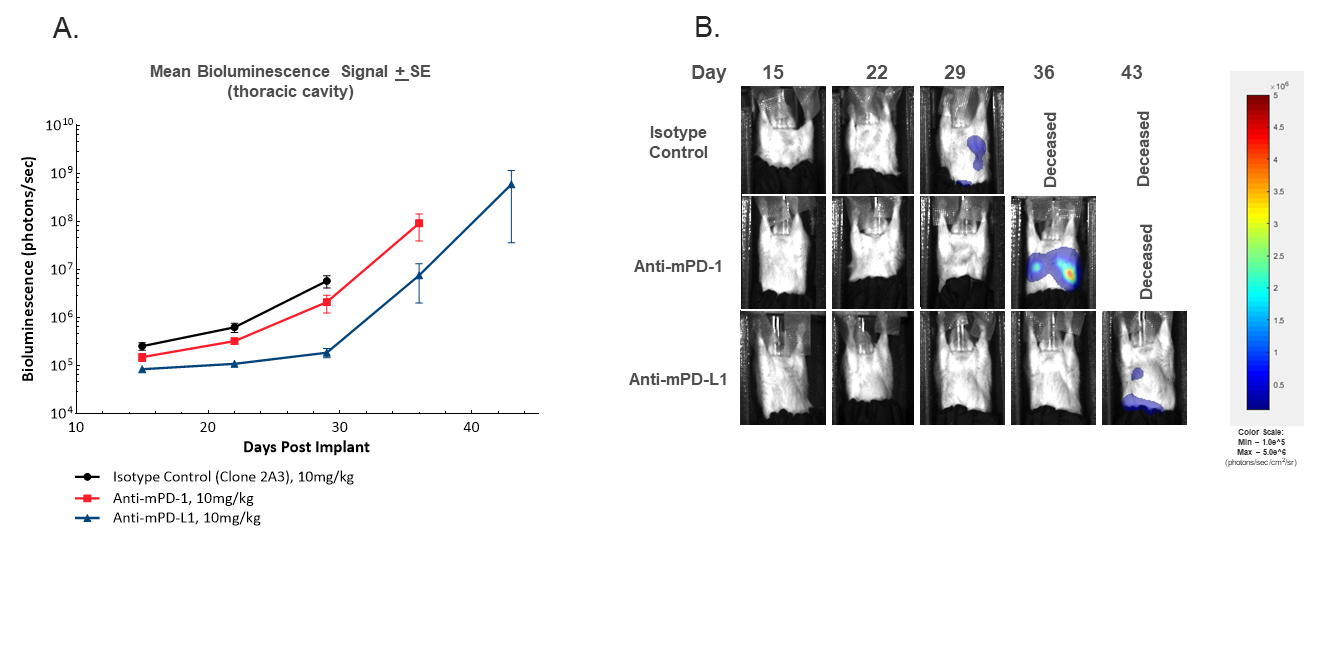
除了通过原发性MFP肿瘤测量评估对治疗的反应外,荧光素酶激活的细胞系还允许通过评估BLI信号定位来监测胸部转移的发展体内. 胸部信号的发展如图3所示。正如预期的那样,BLI的监测提供了转移发生程度的额外粒度,以及抗-mPD-1或抗-mPD-L1治疗对转移参与的任何延迟。在研究过程中,所有对照组动物的胸部BLI信号均增强,但大体尸检时,这些动物均未显示转移性结节(数据未显示)。虽然病理学评估对于确认胸部信号增加的病因是必要的,但在未治疗动物尸检时对肺结节的历史观察强烈表明,信号增加是由于转移引起的,突出了这一终点的价值。基于这一假设,我们可以得出结论,抗mPD-L1治疗导致转移的延迟发生与原发肿瘤生长的延迟一致。值得注意的是,该模型中的转移不会导致健康状况的下降,因为在转移影响健康之前,小鼠退出了原发性肿瘤负担的研究。
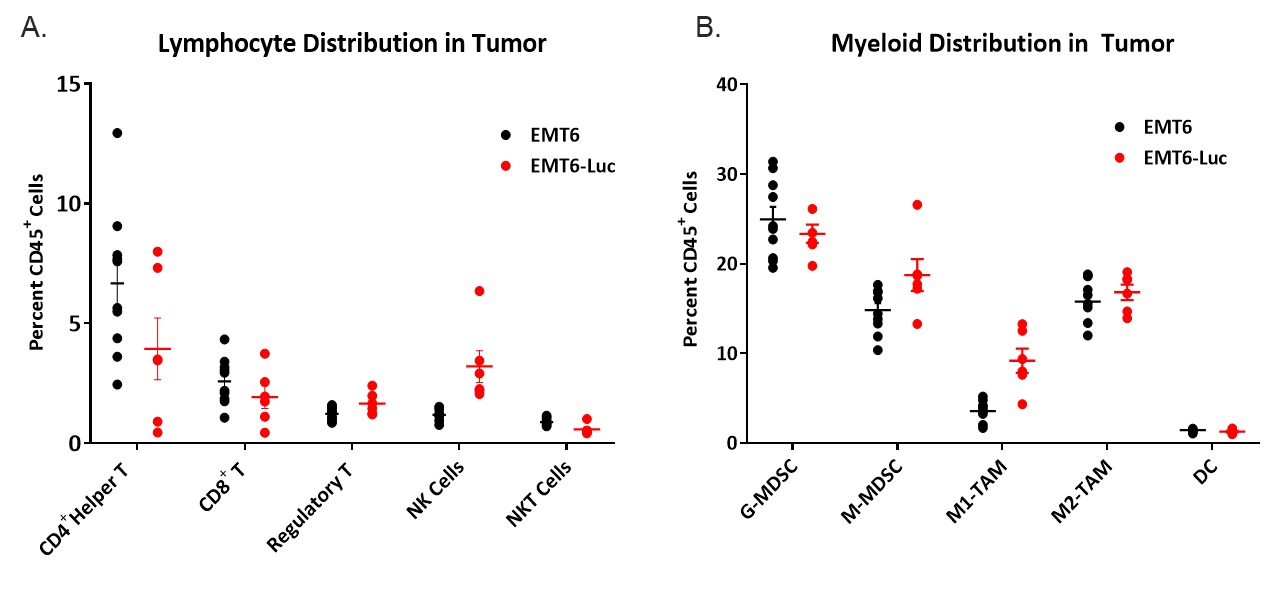
为了免疫肿瘤学的目的而询问模型时,了解浸润到肿瘤中的免疫细胞的组成也很重要。为此,幼稚的肿瘤在150-550毫米之间三检测浸润的T细胞和骨髓细胞占总CD45的百分比+单元格(图4)。所有肿瘤的髓样腔均匀分布于M2巨噬细胞、单核细胞MDSCs和粒细胞MDSCs。M1巨噬细胞浸润相对低于其他髓系来源细胞,EMT6-Luc肿瘤中M1巨噬细胞浸润略高于EMT6肿瘤。CD4的浸润+和CD8+在EMT6和EMT6-Luc肿瘤中,T细胞数量极少,但一致,而在EMT6-Luc肿瘤中,NK细胞数量略有增加。此组合物暗示免疫抑制微环境,其有助于解释所测试免疫治疗方案的有限反应。
EMT6-Luc小鼠乳腺癌模型具有良好的免疫特性,充分利用了小鼠的完整免疫系统,是免疫肿瘤学领域的有力工具。这些数据支持使用EMT6-Luc模型作为一种可靠的临床前免疫肿瘤学模型,用于评估原发性肿瘤生长和远处胸部转移的形成。yaboapp体育官网
请联系科文斯与我们的科学家交谈关于EMT6-Luc,或者我们的其他同基因模型,如何用于你的下一个免疫肿瘤学研究。
参考文献:
1“美国癌症协会:癌症事实与统计。”美国癌症协会|癌症事实与统计,加利福尼亚州癌症统计中心.cancer.org/?_ga=2.5394928.293340281.1606765768-996476487.1605734560。
2Howlader N、Noone AM、Krapcho M、Miller D、Brest A、Yu M、Ruhl J、Tatalovich Z、Mariotto A、Lewis DR、Chen HS、Feuer EJ、Cronin KA(编辑)。SEER癌症统计回顾,1975-2017,国家癌症研究所。马里兰州贝塞斯达,https://seer.cancer.gov/csr/1975\u 2017年/,基于2019年11月SEER数据提交,发布于SEER网站,2020年4月。
三Leal JHS和McArthur H.乳腺癌免疫治疗:从生物学到当前临床应用。欧元。地中海。J、 ,2020年;5(2): 113-124.
4罗克韦尔SC,卡尔曼,右前,法贾尔多,左前。小鼠乳腺肿瘤连续移植的特性及其组织培养适应的衍生物。J、 纳特尔。可以。安装。, 1972; 49(3): 735–749.