Pan02-Luc:胰腺癌原位模型
随着发展的日益复杂免疫疗法,生物技术/制药公司现在正在寻找更相关和准确的yaboapp体育官网临床肿瘤模型准确预测药物反应。
虽然临床前肿yaboapp体育官网瘤学研究旨在在动物环境中模拟人类疾病,但研究人员面临的最大挑战是结果的可转译性。理想的临床前肿瘤模yaboapp体育官网型不仅要考虑特定的肿瘤亚型,还要模拟肿瘤发生所需的复杂微环境。
最近的几种出版物表明,肿瘤植入物的部位会影响临界参数,如肿瘤动力学,血管化,建筑,缺氧环境以及对抗肿瘤治疗的敏感性1-4.
使用频率越高皮下(SC)模型具有使用卡尺监测肿瘤测量的优点。然而,它们在形态、血管密度、免疫细胞浸润和肿瘤微环境等方面与内脏肿瘤不同。这正是一个原位(OT)肿瘤模型试图捕获,例如,植入肿瘤细胞系或病人来源的异种移植物到匹配的组织类型的器官。
在免疫疗法的具体背景下,已发表的数据表明,OT肿瘤模型是免疫抑制,具有较大丰度的巨噬细胞,并且对某些类型的免疫疗法可能比同一模型植入皮下的相同模型敏感2.
为了探索与SC相比,OT模型提供更相关的肿瘤微环境,同时也作为肿瘤的主要位置的潜力,我们使用荧光素酶使若干同基因细胞系能够促进肿瘤进展和转移的非侵入性监测。
在这里,在这种型号聚焦中,我们介绍了鼠胰腺腺癌细胞系的Pan02-Luc的模型开发。注意:所有的动物工作都由网站机构动物护理和使用委员会批准,并与其一致进行实验动物的护理和使用指南在AAALAC认可的计划中。在体重和定义的临床观察的基础上预先确定人文的安乐死标准。
PAN02-LUC的模型开发:鼠胰腺腺癌细胞系
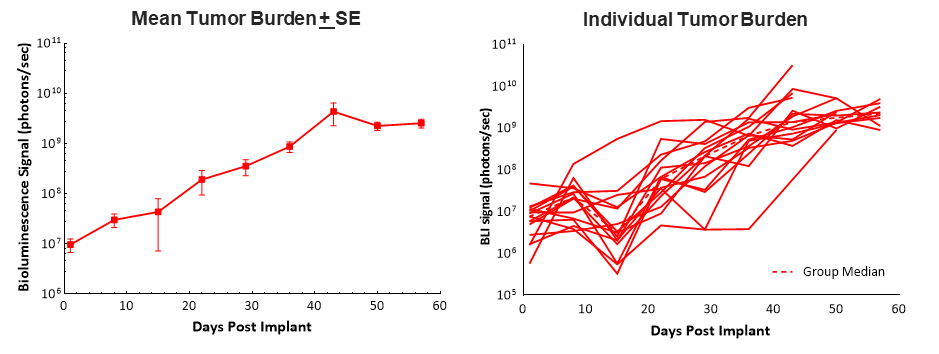
在C57BL / 6小鼠中,PAN02-LUC细胞的外科植入胰腺中的胰腺头部导致〜100%肿瘤,稳定肿瘤生长,中值倍增时间为6天生物发光成像(BLI).动物的中位数较长的生存(发病率/死亡率)时间为58天,允许该模型中的5-6周的剂量和功效评估(图1)。肿瘤植入和进展对体重没有任何不利影响,以及导致安乐死的最常见的临床观察是腹胀(数据未显示)。
1.在C57BL / 6小鼠中植入植物植入的PAN02-LUC的生长动力学
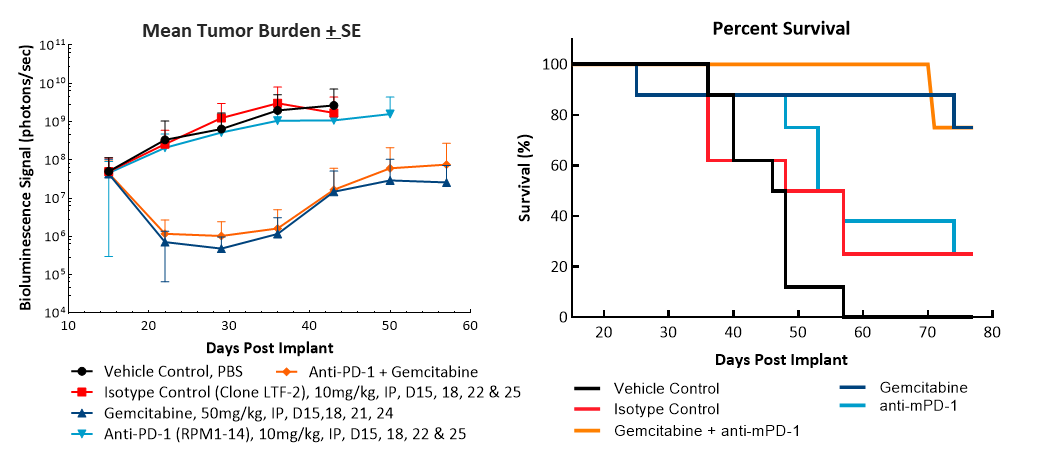
众所周知,胰腺癌被认为是“冷”肿瘤,对免疫治疗不响应良好。因此,我们单独测试检查点抑制剂抗MPD-1,与吉西他滨组合。
治疗后疗效评价anti-mPD-1(10毫克/公斤)并没有显示出任何有意义的反应(图2)。治疗的临床相关的标准护理化疗剂吉西他滨(50毫克/公斤)导致完整的肿瘤回归(CR) 87%(7/8)的动物和62%(5/8)被认为肿瘤幸存者(TFS)由自由BLI. Regrowth was observed in two animals after the end of treatment. The combination of gemcitabine with anti-mPD-1 did not result in any additional TFS over single agent gemcitabine. Representative bioluminescence images (Fig. 2C) and histology images (Fig. 2D) from tumors taken at the end of the study confirm tumor regression in the gemcitabine treated groups.
图2所示。Pan02-Luc对抗mpd -1和吉西他滨治疗的反应
一个。
B。

C。
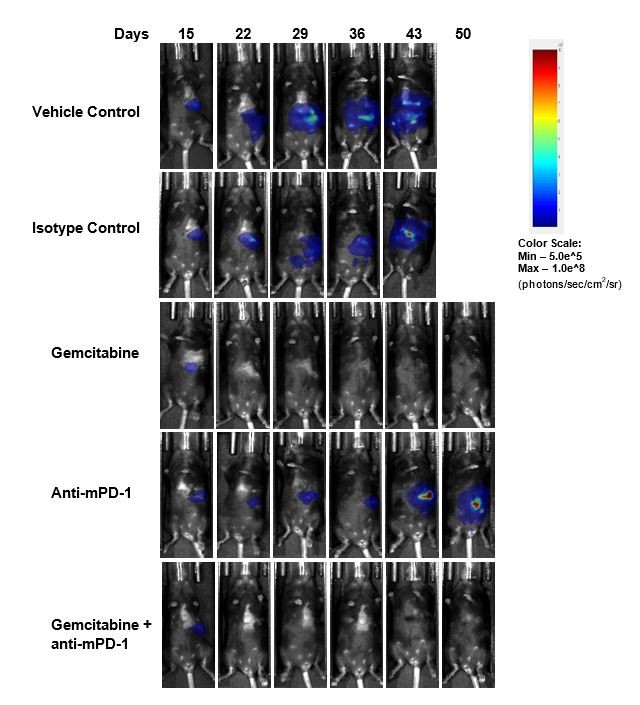
D。
我们之前曾报道过皮下Pan02模型对免疫治疗的反应(看到以前的模型聚光灯).因此,与此显示的Luc激活Pan02细胞系的OT数据相比,我们发现OT模型对抗mpd -1的反应与SC亲本Pan02模型相似。对于吉西他滨,给予相同剂量浓度,在OT模型中显著高于SC模型,在SC模型中,动物表现出肿瘤生长延迟和80%的PR(部分回归),20%的CR,没有TFS(表1)。
表1。比较SC和OT Pan02肿瘤对吉西他滨治疗的反应
Anti-mPD-1 |
吉西他滨 |
|||
|---|---|---|---|---|
SC. |
ot. |
SC. |
ot. |
|
偏回归(PR) |
0% |
25% |
80% |
12% |
完整的回归(CR) |
0% |
12.5% |
20% |
87% |
无肿瘤幸存者(TFS) |
0% |
0% |
0% |
62% |
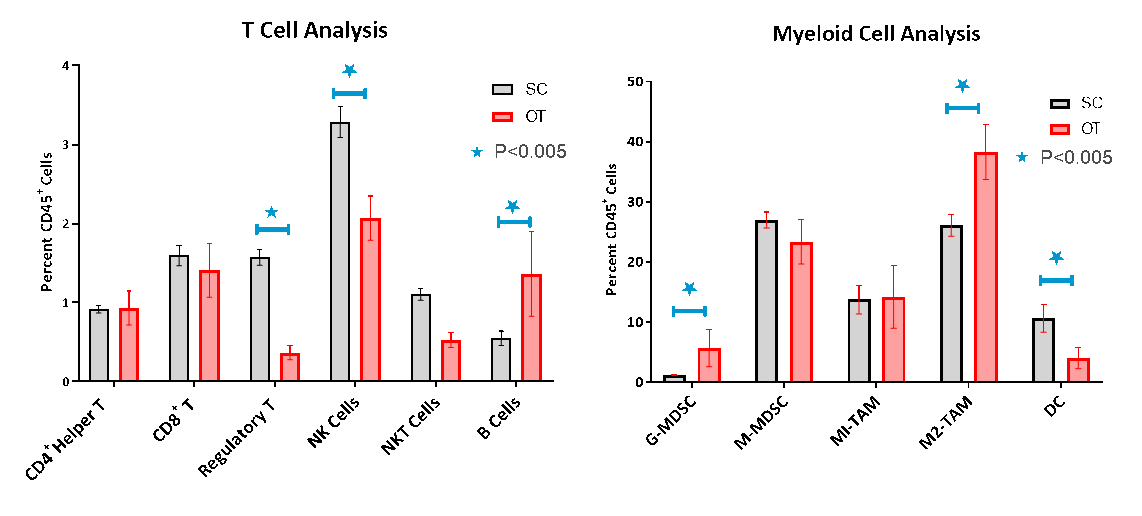
通过流式细胞术评估OT肿瘤的免疫细胞浸润,证实了非免疫原性或“冷”肿瘤模型的淋巴样细胞浸润较差的特征(图3A-B)。而CD8+和CD4.+辅助T细胞仅占CD45的1.6%和1%+分别群体分别与单核糖 - 骨髓衍生的抑制细胞(MSCS)和M2肿瘤相关的巨噬细胞(TAMS)存在于富含单核细胞 - 骨髓衍生的抑制细胞(M2肿瘤)的群体中存在。OT和SC模型的免疫谱的比较显示出调节T细胞(Tregs),天然杀伤细胞(NK)和天然杀伤T细胞(NKT)细胞在OT肿瘤中显着降低。一般而言,骨髓种群在肿瘤中较大,肿瘤占CD45的82%+细胞,而在SC模型中,它在68%。OT肿瘤的粒细胞-MDSCs和M2-Tams显着较高,而树突细胞较低并指示更抗炎免疫抑制表型。
图3所示。SC和OT肿瘤的流式细胞术分析
一个。
B。
在我们看来,SC和OT模型之间的这些细微差异可能为我们所研究的治疗的反应强度提供了见解。据报道,这些差异是至关重要的临床,因为他们影响反应的可预测性和预后的胰腺癌患者5 - 7。
原位肿瘤植入能够以更好的方式模拟临床情景的方式提供癌症进展和药物反应的建模。由于每个器官及其微环境是独一无二的,并且不能被皮下植入复制,因此在可用时使用原位模型非常重要。
在Covance临yaboapp体育官网床肿瘤学,我们为此目的提供了几个启用荧光素酶的模型。
如果您有兴趣进一步讨论此模型,请与我们联系。
引用:
1. Ertersad DJ等,2018年,胰腺癌的原位和异位小鼠模型及其对Folfirinox化疗的不同反应。DIS模型机械。,7月1日;11(7):DMM034793
2.Devaud C等,2014。不同解剖部位的组织可以塑造和改变肿瘤微环境,以影响对治疗的反应。摩尔。, 1月22日(1):18-27
3.Guerin MV, Finisguerra V, Van den Eynde BJ, Bercovici N and Trautmann A, 2020。yaboapp体育官网临床前小鼠肿瘤模型:结构和功能的观点。eLife。, 2020; 9: e50740
4.Qui W和Su GH。2013.原位胰腺肿瘤小鼠模型的建立。杂志的方法。980:215 - 223
5.Kurahara H等,2011。m2极化的肿瘤相关巨噬细胞在胰腺癌中的意义外科研究,5月15日;167 (2): e211-e219
6.Parente P,等,2018。胰管腺癌肿瘤微环境与免疫系统间的对话:新治疗方法的潜在靶点。胃肠病学研究与实践。2018:7530619
7.Lankadasari M等,2019。治疗胰腺癌:一把双刃剑。摩尔癌症18:48
注:研究按照适用的AAALAC认可的设施中的动物福利法规
作者:
Sumithra Urs,Ph.D.,科学家,科学发展
日期:
2020年10月